- 首页
-
产品
- 多分散聚乙二醇衍生物
- 单分散聚乙二醇衍生物
- 脂质
- 脂肪酸修饰侧链
-
嵌段共聚物
- 线性两嵌段
- 双V两嵌段
- H型两嵌段(Y嵌段和V嵌段的组合,或两个Y的组合)
- 1+3臂两嵌段
- 线性三嵌段(ABA,BAB,ABC)
- 三臂Y型两嵌段(V+I型,也可以称为T型)
- 三臂三嵌段(3个臂都不一样的嵌段)
- H型三嵌段(中间一型嵌段,和两头I或V型嵌段)
- H型三嵌段II(中间H型嵌段,和四个I型末端嵌段)
- H型三嵌段III(中间一,两头Y)
- 星型多嵌段(中间星型和中间环型嵌段)
- 单官能化线性两嵌段
- 双官能化线性两嵌段
- 异端官能化线性两嵌段
- 双V(单嵌段双官能化)两嵌段(一个V嵌段的两个末端是一样的官能化)
- 双V(异嵌段双官能化)两嵌段
- H型(单嵌段双官能化)两嵌段(Y嵌段和V嵌段的组合,或两个Y的组合)
- H型(异嵌段双官能化)两嵌段(Y嵌段和V嵌段的组合,或两个Y的组合)
- 1+3臂(单嵌段双官能化)两嵌段
- 1+3臂(三官能化)两嵌段
- 1+3臂(异嵌段双官能化)两嵌段
- 单官能化线性三嵌段(ABA,BAB,ABC)
- 双官能化线性三嵌段(ABA,BAB,ABC)
- 异官能化线性三嵌段(ABA,BAB,ABC)
- 三臂Y型(单嵌段I单官能化)两嵌段(V+I型,也可以称为T型)
- 三臂Y型(单嵌段V双官能化)两嵌段(V+I型,也可以称为T型)
- 三臂Y型(三官能化)两嵌段(V+I型,也可以称为T型)
- 三臂Y型(嵌段I和V异官能化)两嵌段(V+I型,也可以称为T型)
- 三臂(单嵌段官能化)三嵌段(3个臂都不一样的嵌段)
- 三臂(两嵌段双官能化)三嵌段(3个臂都不一样的嵌段)
- 三臂(两嵌段异官能化)三嵌段(3个臂都不一样的嵌段)
- 三臂(三官能化)三嵌段(3个臂都不一样的嵌段)
- 三臂(三嵌段异官能化)三嵌段(3个臂都不一样的嵌段)
- H型(I或V单嵌段双官能化)三嵌段(中间一型嵌段,和两头I或V型嵌段)
- H型(四官能化)三嵌段(中间一型嵌段,和两头I或V型嵌段)
- H型(I或V单嵌段异官能化)三嵌段(中间一型嵌段,和两头I或V型嵌段)
- H型(I单嵌段双官能化)三嵌段II(中间H型嵌段,和四个I型末端嵌段)
- H型(四官能化)三嵌段II(中间H型嵌段,和四个I型末端嵌段)
- H型(I单嵌段异官能化)三嵌段II(中间H型嵌段,和四个I型末端嵌段)
- H型(Y单嵌段双官能化)三嵌段III(中间一,两头Y)
- H型(四官能化)三嵌段III(中间一,两头Y)
- H型(双Y嵌段双官能化)三嵌段III(中间一,两头Y)
- H型(双Y嵌段异官能化)三嵌段III(中间一,两头Y)
- 官能化星型多嵌段(中间星型和中间环型嵌段)
- 聚两性离子
- 聚酯
- 糖类
- 其他辅料
- 转染试剂
- 蛋白修饰
- 多肽修饰
- GLP-1修饰
- GLP-1辅料
- 水凝胶
- 3D打印
- 点击化学物质
- PROTAC/ADC Linker
- 与各种官能团的反应
- mRNA递送
- 小核酸递送
- 脂质体
- 聚合物胶束
- PEG标准品
- PEG辅料
- 转染
- 根据官能团分类
- 技术
- 服务
- 新闻
- 联系


- 首页
-
- 线性两嵌段
- 双V两嵌段
- H型两嵌段(Y嵌段和V嵌段的组合,或两个Y的组合)
- 1+3臂两嵌段
- 线性三嵌段(ABA,BAB,ABC)
- 三臂Y型两嵌段(V+I型,也可以称为T型)
- 三臂三嵌段(3个臂都不一样的嵌段)
- H型三嵌段(中间一型嵌段,和两头I或V型嵌段)
- H型三嵌段II(中间H型嵌段,和四个I型末端嵌段)
- H型三嵌段III(中间一,两头Y)
- 星型多嵌段(中间星型和中间环型嵌段)
- 单官能化线性两嵌段
- 双官能化线性两嵌段
- 异端官能化线性两嵌段
- 双V(单嵌段双官能化)两嵌段(一个V嵌段的两个末端是一样的官能化)
- 双V(异嵌段双官能化)两嵌段
- H型(单嵌段双官能化)两嵌段(Y嵌段和V嵌段的组合,或两个Y的组合)
- H型(异嵌段双官能化)两嵌段(Y嵌段和V嵌段的组合,或两个Y的组合)
- 1+3臂(单嵌段双官能化)两嵌段
- 1+3臂(三官能化)两嵌段
- 1+3臂(异嵌段双官能化)两嵌段
- 单官能化线性三嵌段(ABA,BAB,ABC)
- 双官能化线性三嵌段(ABA,BAB,ABC)
- 异官能化线性三嵌段(ABA,BAB,ABC)
- 三臂Y型(单嵌段I单官能化)两嵌段(V+I型,也可以称为T型)
- 三臂Y型(单嵌段V双官能化)两嵌段(V+I型,也可以称为T型)
- 三臂Y型(三官能化)两嵌段(V+I型,也可以称为T型)
- 三臂Y型(嵌段I和V异官能化)两嵌段(V+I型,也可以称为T型)
- 三臂(单嵌段官能化)三嵌段(3个臂都不一样的嵌段)
- 三臂(两嵌段双官能化)三嵌段(3个臂都不一样的嵌段)
- 三臂(两嵌段异官能化)三嵌段(3个臂都不一样的嵌段)
- 三臂(三官能化)三嵌段(3个臂都不一样的嵌段)
- 三臂(三嵌段异官能化)三嵌段(3个臂都不一样的嵌段)
- H型(I或V单嵌段双官能化)三嵌段(中间一型嵌段,和两头I或V型嵌段)
- H型(四官能化)三嵌段(中间一型嵌段,和两头I或V型嵌段)
- H型(I或V单嵌段异官能化)三嵌段(中间一型嵌段,和两头I或V型嵌段)
- H型(I单嵌段双官能化)三嵌段II(中间H型嵌段,和四个I型末端嵌段)
- H型(四官能化)三嵌段II(中间H型嵌段,和四个I型末端嵌段)
- H型(I单嵌段异官能化)三嵌段II(中间H型嵌段,和四个I型末端嵌段)
- H型(Y单嵌段双官能化)三嵌段III(中间一,两头Y)
- H型(四官能化)三嵌段III(中间一,两头Y)
- H型(双Y嵌段双官能化)三嵌段III(中间一,两头Y)
- H型(双Y嵌段异官能化)三嵌段III(中间一,两头Y)
- 官能化星型多嵌段(中间星型和中间环型嵌段)
- 技术
- 服务
- 新闻
- 联系
 热门产品
热门产品
-
06040002900 索马鲁肽羧酸修饰剂详情
-
06040007100 GIP/GLP-1双重激动剂侧链(Tirzepatide侧链)详情
-
06020112302 06020112306 06020112309 06020112312 06020112313 06020112315 甲氧基聚乙二醇双十四烷基乙酰胺详情
-
06020112402 06020112406 06020112409 06020112412 06020112413 06020112415 甲氧基聚乙二醇二肉豆蔻酰甘油详情
-
06040008900 4-(N,N-二甲基氨基)丁酸(二亚油基)甲酯详情
-
C029 8-(2-羟基苯甲酰胺基)辛酸钠详情
-
06040005400 诺和长效生长激素侧链详情
-
06020100123 06020100160 06020100101 06020100102 06020100119 06020100103 06020100104 06020100106 06020100179 06020100109 06020100110 06020100112 06020100148 06020100161 06020100113 06020100115 06020100121 06020100126 06020100127 06020100128 06020100129 06020100130 06020100131 06020100132 06020100133 06020100134 甲氧基聚乙二醇详情
-
06020100402 06020100406 06020100409 06020100412 06020100415 06020100425 06020100426 06020100427 06020100428 06020100430 06020100432 甲氧基聚乙二醇乙酸详情
安全有效地全身递送mRNA到体内特定器官和细胞仍然是开发基于mRNA的疗法的主要挑战。与mRNA共配制的系统给药脂质纳米颗粒(LNP)的靶向主要局限于肝脏和脾脏。
这里的一些研究来源于许巧兵教授团队,使用文库筛选方法,发现N系列LNPs(尾部含有酰胺键)能够选择性地将mRNA递送到小鼠肺,发现O系列LNPs(尾部含有酯键)倾向于将mRNA递送到肝脏, 发现基于咪唑的LNPs优先将mRNA靶向脾脏。并使用液相色谱-质谱分析了肝和肺靶向LNPs上的蛋白冠,并鉴定了一组独特的血浆蛋白,这些蛋白质特异性地吸附在表面,可能有助于这些LNPs的靶向性。通过简单地调整N系列LNPs的头部结构,也可以靶向不同的肺细胞类型。
重要的是,这里证明了基于LNP的RNA治疗在淋巴管平滑肌瘤病(LAM)的临床前模型中的成功,LAM是一种由Tsc2基因功能丧失突变引起的破坏性肺部疾病。肺靶向LNP高效递送小鼠结节性硬化复合物2(Tsc2)mRNA用于修复肿瘤中的TSC2抑癌基因,并在减轻肿瘤负荷方面取得了显著的治疗效果。确立了mRNA LNPs作为治疗LAM的有前景的治疗干预措施。
由于mRNA主要在全身递送后积聚在肝脏和脾脏中,迄今为止,大部分临床兴趣都集中在肝脏疾病上。迫切需要能够将特异性mRNA递送到肝外组织的递送载体,以充分发挥基于mRNA的治疗的潜力。目前已经做出了相当大的努力来开发器官靶向LNPs,通过用肽、抗体和蛋白质等靶向部分修饰LNPs的表面来绕过肝脏积累。
10.1021/acschembio.0c00003开发了用α血浆囊泡相关蛋白抗体功能化的靶向LNP,用于体内肺靶向mRNA递送。10.1038/s41565-020-0669-6开发了一种选择性器官靶向(SORT)策略,以设计和调整LNP的生物分布,掺入额外的赋形剂SORT分子可以精确改变体内mRNA递送曲线。
这些策略在减轻肝脏积累和将mRNA输送到肺或脾脏方面表现出优势。这些有希望的发展激励研究人员继续探索将mRNA递送到特定位置的创新方法。
对于类脂尾部化学,尽管在了解脂质尾长、不饱和度和支化度对mRNA递送效力的影响方面取得了相当大的进展,但类脂尾部结构对LNP体内选择性的影响仍然知之甚少。为了解决这一重要的知识空白,通过胺头和丙烯酰胺尾之间的迈克尔(Michael)加成反应合成了一个含酰胺键的脂质(N系列LNPs)库(图1 A)。通过体内筛选,发现N系列LNPs在全身给药后几乎只将mRNA递送到肺部(图1 B和C)。尾部含有酯键的O系列LNPs倾向于将mRNA递送到肝脏中(图2A)。使用蛋白质组学,鉴定了一组独特的血浆蛋白,这些蛋白特异性地吸附在两个代表性的LNP候选物306-O12B和306-N16B的表面,这可能会影响这些LNPs的靶向性。更重要的是,通过改变N系列LNPs的脂质头部结构可以靶向不同的肺细胞亚群。
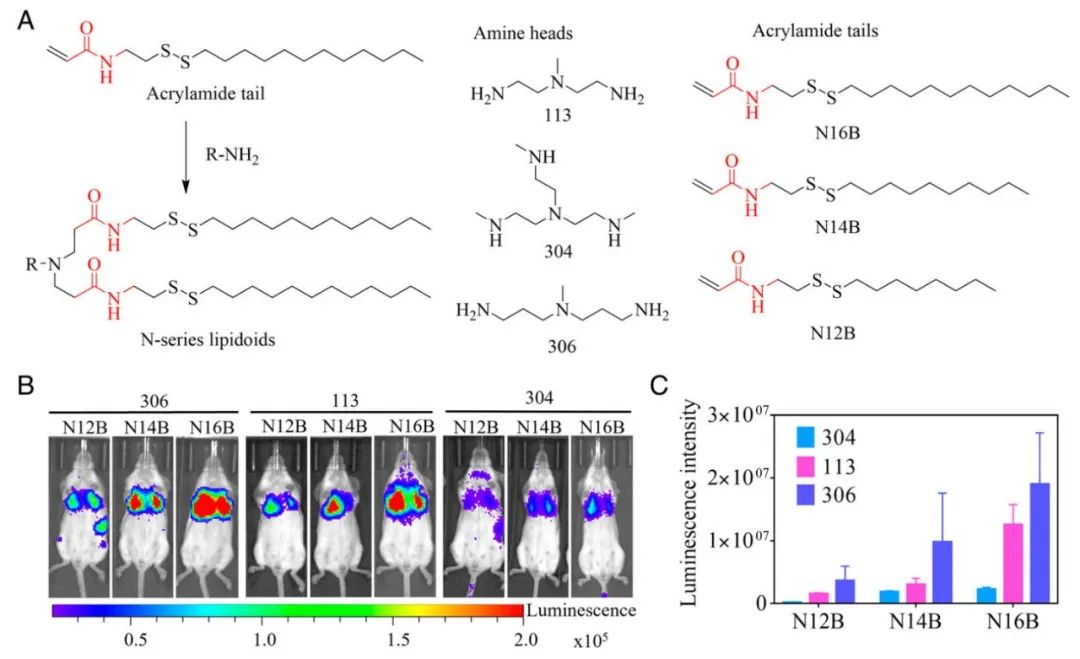
●图1 N系列LNPs的合成和体内筛选。(A)类脂质的合成路线和代表性化学结构。通过IVIS成像系统测量的小鼠的代表性全身生物发光图像(B)和N系列LNP的体内mRNA递送效率(C)。小鼠以0.5mg / kg的单剂量注射Luc mRNA负载的N系列LNP中的任何一种。在注射后6h(n = 3)拍摄图像。
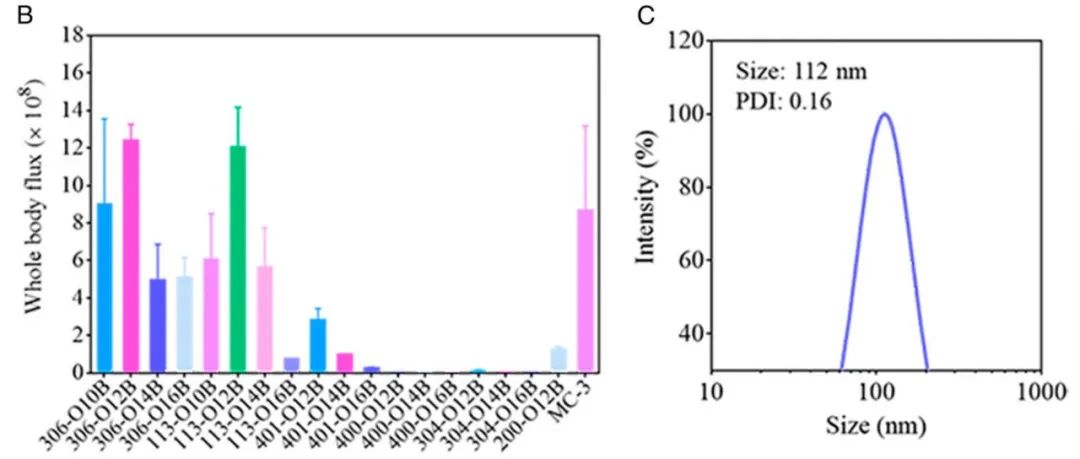
●图2 O系列LNPs的合成和体内筛选。(A)尾部分枝生物还原类脂的化学结构。(B)给药后6h,Balb/c小鼠(n=3)测定可生物还原LNPs与MC3 LNP的荧光素酶生物发光强度。配方:LNP/胆固醇/DSPC/DMG-PEG=50/38.5/10/1.5(摩尔比),LNP/mRNA=12.5/1(重量比)。(C)用DLS法测量由fLuc mRNA形成的306-O12B LNPs的大小和分布。
N系列LNPs的合成和mRNA负载LNPs的体内筛选
使用无溶剂迈克尔加成反应将丙烯酰胺尾部(N16B、N14B和N12B)与不同的胺头反应,从而生成了9种可生物还原的N系列类脂(图1A)。然后将LNPs与用先前优化的LNP配方进行配制,用于mRNA递送,其中摩尔比是50%合成的LNPs、38.5%胆固醇、10% DOPC和1.5% DMG-PEG2000。为了研究这些LNPs在体内的全身性mRNA递送情况,包裹编码萤火虫荧光素酶的萤火虫荧光素酶mRNA(fLuc mRNA),萤火虫荧光素酶是一种可以使用IVIS成像系统(Perkin-Elmer)在体内可视化的报告蛋白。有趣的是,N系列LNPs处理小鼠的生物发光信号主要位于肺部(图1B)。
此外,发现脂质的化学结构在决定所配制的LNPs的体内mRNA递送效率中起着关键作用。如图1C所示,注射后6 h肺部荧光素酶生物发光强度的定量表明,与304和113 LNPs相比,306胺头掺入的LNPs表现出最高的递送效率。递送效率也随着类脂质尾长的增加而提高,与具有N14B或N12B尾部的脂质相比,具有N16B尾部的脂质表现出最高的效率。为了研究辅助脂质(如DOPC)是否在这些N系列脂质的肺靶向递送中起作用,在保持胆固醇和DMG-PEG2000不变的情况下,用DSPC和DOPE等辅助脂质配制了306-N16B。
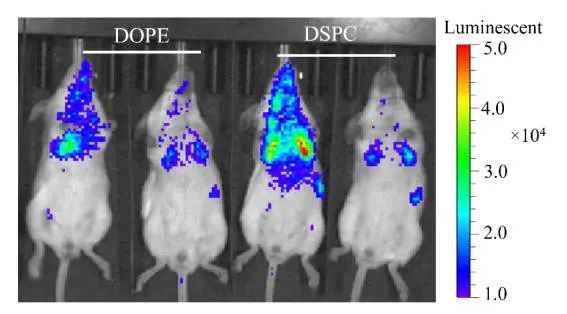
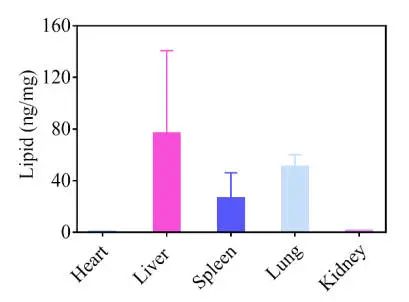
● 图S1
如图S1,LNP制剂使用可电离脂质306-N16B与辅助脂质DOPE或DSPC也导致蛋白质主要在肺中表达,尽管当使用辅助脂质DOPC时蛋白质产生较少(图1B)。这些结果表明,活性类脂质(如306-N16B),而不是辅助脂质,负责使用N系列LNPs进行肺靶向递送。
● 图S2
然后,研究了306-N16B LNP-mRNA复合物的生物分布,以了解观察到的器官选择性蛋白表达。通过尾静脉注射将负载Luc mRNA的LNPs注射到Balb/c小鼠体内。注射后4h处死小鼠并取器官,然后提取器官中的306-N16B并用质谱定量,发现306-N16B不仅在肺部检测到,而且在肝脏和一些脾脏中也检测到(图S2),而荧光素酶仅在肺部表达(图1B)。虽然肝和脾中没有检测到蛋白质表达的具体机制仍有待阐明,但这些结果表明LNP器官积累与细胞摄取和蛋白质表达之间并不总是存在相关性。
通过改变N系列LNPs的胺头结构,可以靶向不同的肺细胞亚群
基于mRNA疗法的临床转化需要将mRNA递送到特定的器官和细胞类型。肺部可能受到由多个细胞区室功能失调引起的许多疾病的影响,包括内皮,上皮和免疫细胞。为了鉴定特异性转染的肺细胞亚群,利用基因工程Cre/LoxP Ai14报告小鼠系来实现tdTomato蛋白的细胞类型特异性表达。给Ai14小鼠注射了两种最有效的肺靶向LNPs(306-N16B和113-N16B)。该实验以编码Cre重组酶的Cre mRNA作为mRNA货物。一旦递送到细胞中,Cre重组酶移除终止盒,并激活tdTomato荧光信号在编辑细胞中表达(图3A)。
如图3 B和C,在306和113-N16B LNP处理小鼠的肺部特异性检测到红色tdTomato信号,并且通过使用肺切片的共聚焦成像观察tdTomato阳性细胞。为了进一步鉴定和定量肺中转染的特定细胞类型,将肺组织处理成单细胞悬液并使用流式细胞术进行分析。306-N16B LNP对肺内皮细胞的转染率为33.6%,而上皮细胞为1.5%,巨噬细胞为1.9%(图3B),表明306-N16B LNP能够选择性地将mRNA递送到肺内皮细胞。相比之下,113-N16B LNP优先向内皮细胞递送Cre mRNA(占总内皮细胞的69.6%),但也递送至巨噬细胞(18.9%)和上皮细胞(7.3%)(图3C)。这些发现表明,通过简单地调整N系列LNPs的头部结构,可以靶向不同的肺细胞群,为与特定肺细胞相关的肺部疾病的潜在治疗应用奠定基础。
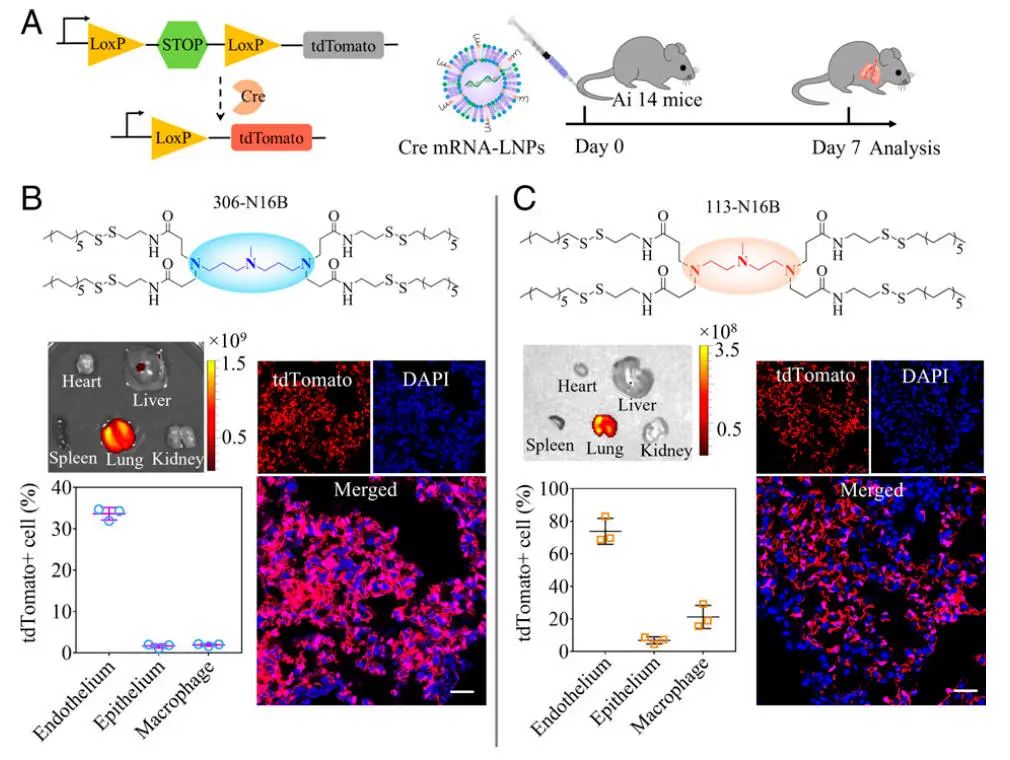
●图3 通过调整N系列LNPs的头部结构,可以靶向不同类型的肺细胞。
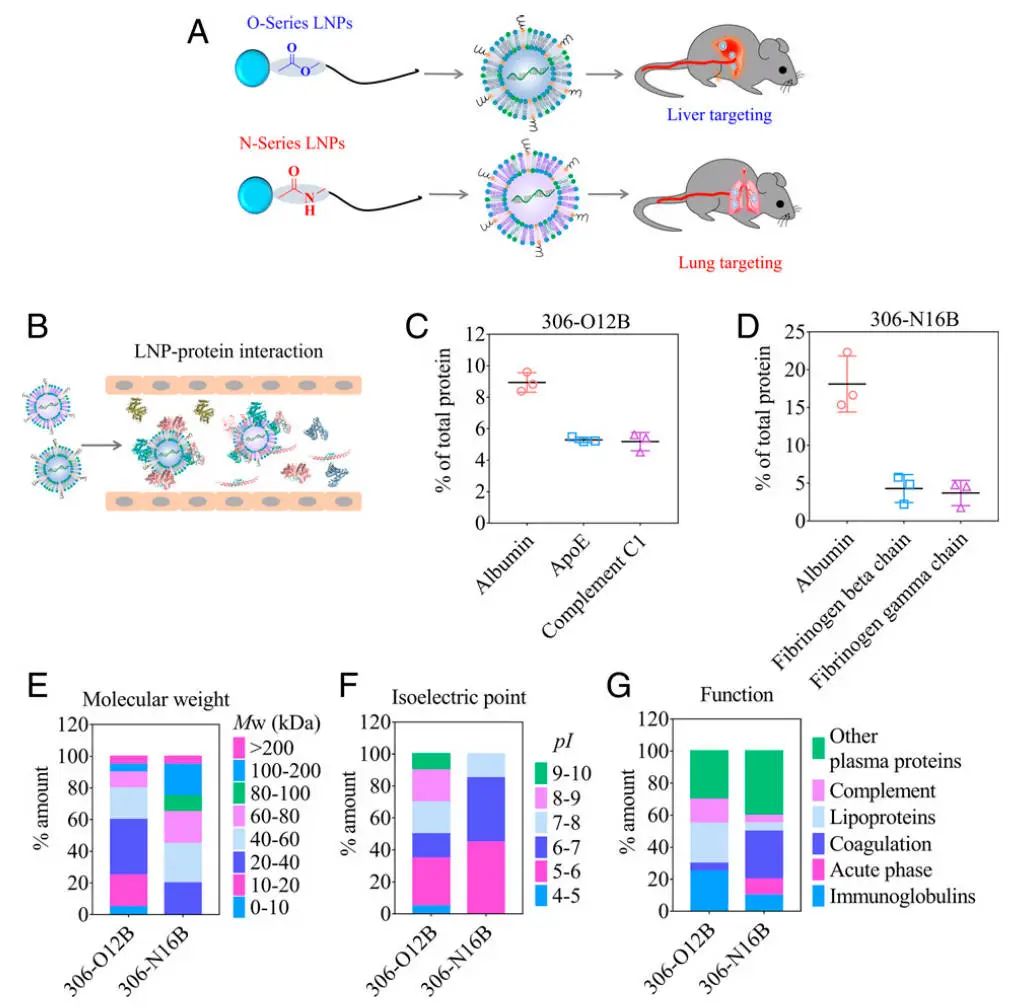
306-O12B和306-N16B LNP蛋白冠组成蛋白质的特性
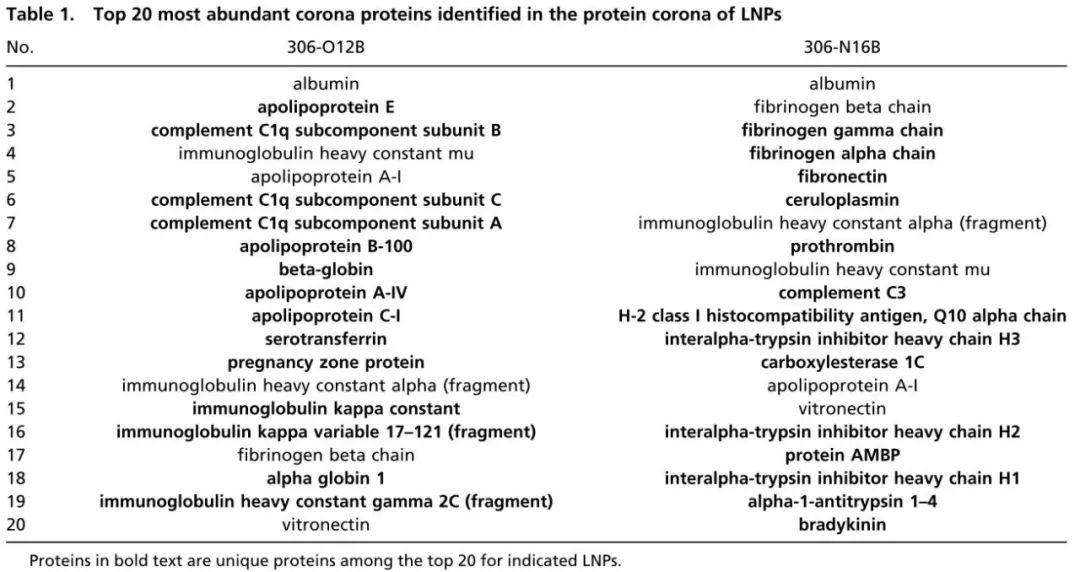
据信,纳米颗粒(NPs)的外表面在静脉内给药后不久立即被一层生物分子冠掩盖,这可以显着改变NPs的表面性质并决定其体内命运。NPs表面上特定血浆蛋白的受控吸附可能会选择性地将NPs引导到特定器官。假设O系列和N系列LNPs的体内器官靶向性(图4A)的显着差异可能归因于其表面形成的血清蛋白(图4B)。为了验证这一假设,鉴定并量化了两种代表性LNPs(306-O12B和306-N16B)上的蛋白质。将这两种LNPs与小鼠血浆在37°C下孵育1h,并通过离心分离并回收蛋白质包被的LNPs,用PBS进行洗涤。然后进行蛋白质组学以分析LNPs上蛋白质的组成。分别在306-O12B LNP和306-N16B LNP上鉴定并定量了1838种和1088种蛋白质。
Venn图揭示了306-O12B LNP和306-N16B LNP之间的常见和独特蛋白质(图S3)。在表1中列出了每个LNP的前20种最丰富的冠状蛋白,这些蛋白可能在蛋白冠中起主导作用。发现306-O12B LNP和306-N16B LNP在前20名中只有6种共同的蛋白质,这支持了假设,即LNP表面吸附的蛋白质可能参与体内靶向性。确定ApoE是肝脏冠层中靶向306-O12B LNP的第二主要蛋白质组成(图4C),与先前10.1038/s41565-019-0591-y证明载脂蛋白E(ApoE)介导的LNPs递送到肝脏的研究一致。相比之下,肺靶向306-N16B LNP冠层中的前三种蛋白质是血清白蛋白,纤维蛋白原β链和纤维蛋白原γ链(图4D)。据报道,纤维蛋白原涂层可以改善内皮细胞粘附和内皮化。O系列或N系列LNPs分别由一种特定蛋白质或几种蛋白质的协同作用决定的蛋白冠介导的肝脏或肺靶向mRNA递送的潜在机制需要进一步研究。
●图4 LNPs上形成蛋白冠结构的蛋白质组学研究。
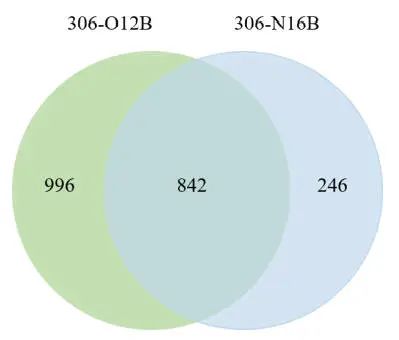
●图S3 Venn图显示了306-O12B LNP(浅绿色)和306-N16B LNP(浅蓝色)上吸附的共同和独特的蛋白质。
根据分子量(Mw)进一步对前20种蛋白质进行了分类(图4E)。306-O12B LNP的蛋白冠富集在低分子量蛋白质中,80%的蛋白质具有Mw<60kDa,而306-N16B LNP的蛋白质冠中有55%的蛋白质>60kDa。还根据蛋白质的等电点(pI)对蛋白质进行了分类,如图4F所示,在生理pH 7.4下显示负电荷(pI < 7)的蛋白质的50%和80%分别构成306-O12B LNP和306-N16B LNP的蛋白冠。有人建议带正电荷的NPs更喜欢吸引带负电荷的蛋白质。然而,在该案例中,没有看到这两种LNPs的zeta电位有显着差异,两种LNPs都显示出轻微的负表面电荷(表S1),表明表面电荷可能不是影响生物体液中NPs和蛋白质之间相互作用的唯一因素。
最后,根据蛋白质的生物学功能对蛋白质进行分类(图4G)。306-O12B LNP和306-N16B LNP富含的蛋白质与脂代谢、补体活化、免疫应答、急性期反应和凝血有关。然而,应该注意的是,除了其他血浆蛋白外,306-O12B LNP的冠层中富集最高的蛋白质是参与脂质和胆固醇代谢的载脂蛋白(图4 G),而凝血相关的冠层蛋白代表306-N16B LNP冠层中最大的部分(图4 G)。总的来说,这些发现表明,在306-O12B LNP和306-N16B LNP上形成的蛋白冠在蛋白质组成生物学功能上存在差异,这可能在确定其体内组织靶向方面发挥关键作用。
Highlight
改变脂质化合物的连接基团可以改变脂质纳米颗粒的器官靶向性:O系列(连接基团为酯键)靶向肝;N系列(连接基团为酰胺键)靶向肺;
调节脂质化合物的头部小分子胺的结构,可改变其对特定组织的细胞靶向性;
纳米颗粒表面形成的蛋白冠(protein corona)影响脂质纳米颗粒的器官靶向性;
体内基因编辑疗法,有望实现长效疾病治疗的目的。
来源:TCRshows
链接:https://mp.weixin.qq.com/s/fXd_bVIFELHw6i1xqBlilQ
如有相关产权问题烦请告知,我司将第一时间删除!
 热门产品
热门产品
-
06040002900 索马鲁肽羧酸修饰剂详情
-
06040007100 GIP/GLP-1双重激动剂侧链(Tirzepatide侧链)详情
-
06020112302 06020112306 06020112309 06020112312 06020112313 06020112315 甲氧基聚乙二醇双十四烷基乙酰胺详情
-
06020112402 06020112406 06020112409 06020112412 06020112413 06020112415 甲氧基聚乙二醇二肉豆蔻酰甘油详情
-
06040008900 4-(N,N-二甲基氨基)丁酸(二亚油基)甲酯详情
-
C029 8-(2-羟基苯甲酰胺基)辛酸钠详情
-
06040005400 诺和长效生长激素侧链详情
-
06020100123 06020100160 06020100101 06020100102 06020100119 06020100103 06020100104 06020100106 06020100179 06020100109 06020100110 06020100112 06020100148 06020100161 06020100113 06020100115 06020100121 06020100126 06020100127 06020100128 06020100129 06020100130 06020100131 06020100132 06020100133 06020100134 甲氧基聚乙二醇详情
-
06020100402 06020100406 06020100409 06020100412 06020100415 06020100425 06020100426 06020100427 06020100428 06020100430 06020100432 甲氧基聚乙二醇乙酸详情


产品需求:sales@sinopeg.com
招贤纳士:sihanyu@sinopeg.com
投诉建议:complains@sinopeg.com
无论您有任何不满或建议,都可填写
下方问卷,将会有专人跟进处理!

中国地区:400-918-9898
国际地区:1-844-782-5734

公司总部:厦门市湖里区泗水道669号厦门国贸商务中心
工厂(一):厦门市翔安区火炬高新区(翔安)产业区建业楼D座
工厂(二):厦门市翔安区马巷镇数字时代广场4号楼


中国地区:400-918-9898
国际地区:1-844-782-5734

产品需求:sales@sinopeg.com
招贤纳士:sihanyu@sinopeg.com
投诉建议:complains@sinopeg.com
无论您有任何不满或建议,都可填写
下方问卷,将会有专人跟进处理!
 TOP
TOP
 TOP
TOP
 在线留言
在线留言







